Witamy na stronie firmy Genomed, poświęconej diagnostyce onkologicznej i profilaktyce nowotworowej
Celem platformy jest udostępnienie danych z zakresu genetycznej diagnostyki onkologicznej i profilaktycznej (płynnej biopsji, badań tkanki nowotworowej) zarówno pacjentom i osobom z rodzin podwyższonego ryzyka choroby nowotworowej, zainteresowanym profilaktyką onkologiczną, jaki i lekarzom oraz ekspertom, zaangażowanym w analizę i interpretację wyników badań dla pacjentów onkologicznych.
Platforma umożliwia:
- uzyskanie dodatkowych informacji dla pacjenta – interpretacja i uzupełnienie wyniku diagnostycznego
- zdalny kontakt ekspertów, opracowujących dane i wyniki dla pacjentów
- zdalny kontakt pacjenta z lekarzem – przeprowadzenie podstawowego lub uzupełniającego wywiadu klinicznego, przekazanie dodatkowych informacji na temat wykrytych, istotnych klinicznie wariantów, informacji o możliwościach doboru farmakoterapii i/lub odpowiednich badań klinicznych.
Platforma powstała w wyniku realizacji projektu pt. "Opracowanie metod nieinwazyjnej diagnostyki genetycznej
i profilaktyki chorób nowotworowych - płynnej biopsji".
Projekt współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Rozwoju Regionalnego,
realizowany w ramach Regionalnego Programu Operacyjnego Województwa Mazowieckiego na lata 2014-2020, Oś
priorytetowa I "Wykorzystanie działalności badawczo-rozwojowej w gospodarce", Działanie 1.2 "Działalność
badawczo-rozwojowa przedsiębiorstw", typ projektów: Projekty badawczo-rozwojowe
Metoda płynnej biopsji
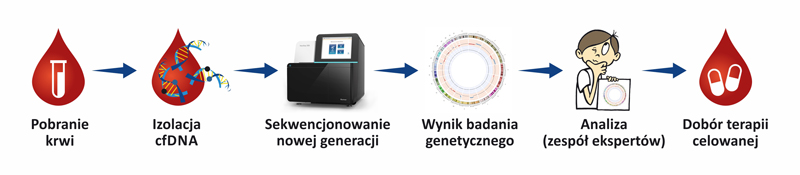
Płynna biopsja to innowacyjna metoda nieinwazyjnej diagnostyki chorób nowotworowych, oparta na analizie pozakomórkowego, wolnego DNA (cfDNA), krążacego w krwi pacjenta.
Dane z ostatnich kilku lat badań wskazują, że w do krwiobiegu osoby z chorobą nowotworową uwalniany jest z komórek nowotworowych, podlegających procesom apoptozy i nekrozy (śmierci komórkowej) wolnokrążący DNA nowotworowy (tzw. circulating tumor DNA, ctDNA), który może potencjalnie służyć jako marker predykcyjny oraz źródło tzw. płynnej biopsji do oceny stopnia zaawansowania procesów neoplastycznych i monitorowania przebiegu leczenia.
Wykrycie w cfDNA tzw. wariantów somatycznych, zmian charakterystycznych dla procesu nowotworowego, występującego u danego pacjenta, stwarza szansę na dobór ukierunkowanej, spersonalizowanej terapii.
Analiza wolnokrążącego DNA, wyizolowanego z osocza krwi, może także umożliwić wykrycie i scharakteryzowanie choroby nowotworowej na bardzo wczesnym etapie, zanim możliwe byłoby jej wykrycie innymi metodami diagnostycznymi, w tym technikami obrazowymi – jest to zastosowanie profilaktyczne płynnej biopsji.
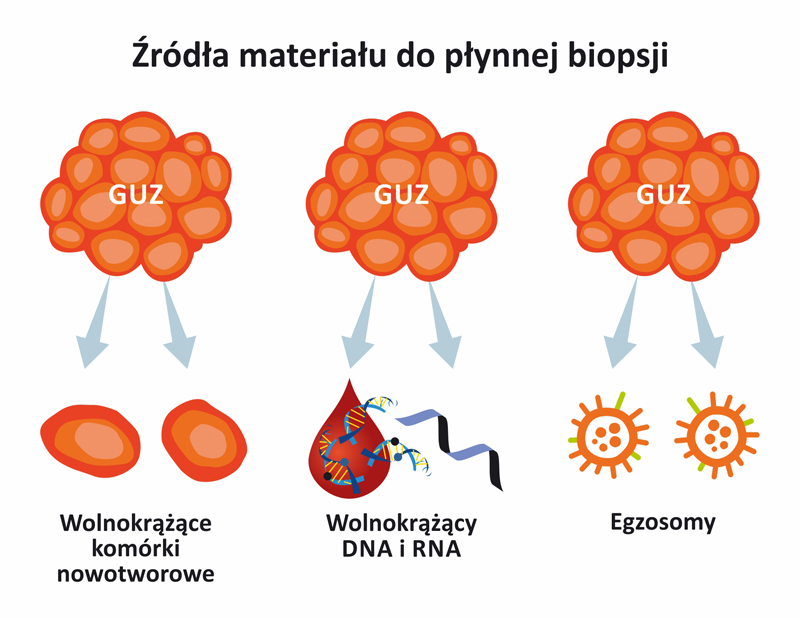
Inne źródła materiału do płynnej biopsji
Wolnokrążące komórki nowotworowe (circulating tumor cells (CTCs)
Wolnokrążące komórki nowotworowe (circulating tumor cells (CTCs) Są to komórki nowotworowe, które oderwały się od guza i trafiły do krwiobiegu pacjenta, wykrywane w różnych typach nowotworów, zasadniczo w późniejszych etapach rozwoju procesu nowotworowego, w nowotworach złośliwych, mają więc mniejsze zastosowanie we wczesnej diagnostyce, większe jako marker predykcyjny.
Egzosomy
Egzosomy to małe, okrągłe pęcherzyki, zawierające min. białka, RNA, DNA, miRNA i metabolity, uwalniane min. przez komórki nowotworowe i wykrywane w krwi oraz innych płynach biologicznych.
Wolnokrążący RNA (cfRNA)
Szczególnie istotny jest wolnokrążący mikro-RNA (cfmiRNA) – krótkie (ok. 22-nukleotydowe), stabilne cząsteczki RNA, regulujące ekspresję genów, które są prawdodobnie specyficzne dla określonych typów nowotworów
Opis technologii
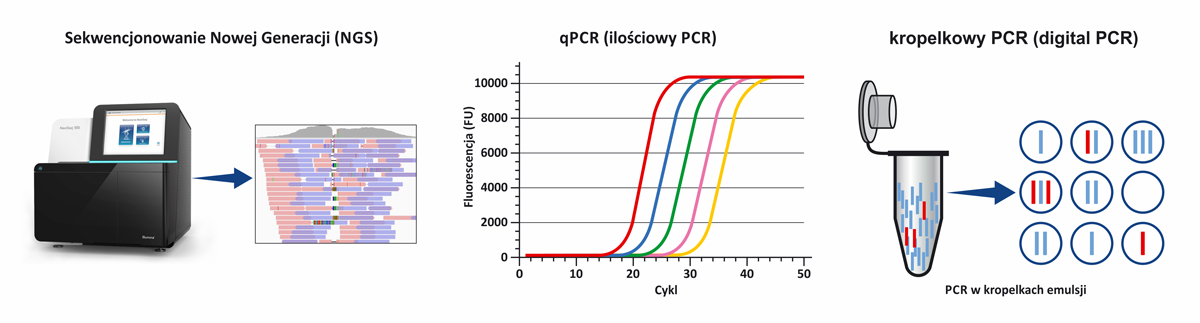
Metodyka zastosowana w płynnej biopsji opiera się na najnowszych osiągnięciach biologii molekularnej – sekwencjonowania następnej generacji (ang. Next-Generation Sequencing, NGS), wykorzystanym zarówno do wykrywania wariantów patogennych (mutacji) w wybranych genach, czy też w ograniczonych regionach genów, związanych z objawami choroby nowotworowej, jak i do analizy całego genomu pacjenta.
Sekwencjonowanie nowej generacji staje się podstawowym narzędziem w diagnostyce genetycznej, zastępując dotychczasowe metody w każdym przypadku, gdy w grę wchodzi choroba o trudnym do ustalenia podłożu genetycznym i gdy konieczna jest analiza znacznych części genomu lub wręcz analiza całogenomowa (ang. Whole Genome Sequencing, WGS), a także, gdy analizowane jest wiele próbek pacjentów jednocześnie, nawet, jeśli dotyczy to tylko wybranych mutacji.
Najczęściej z osocza krwi pacjenta izolowany jest specyficznie tylko wolnokrążący DNA pozakomórkowy, o
długości poniżej 200 par zasad, następnie przygotowywane są tzw. biblioteki DNA , umożliwiające
przeprowadzenie procesu sekwencjonowania nowej generacji. Odpowiednie przygotowanie biblioteki DNA , w
tym
szczególnie etap wzbogacania w sekwencje badanych genów , pozwalają na jednoczesne prowadzenie milionów
reakcji sekwencjonowania, a przez to uzyskanie gigabaz danych genomowych z jednego procesu
sekwencjonowania
NGS.
Ta nowa technologia pozwoliła na ogromne obniżenie kosztów oraz skrócenie czasu analizy genomu
nowotworowego.
Uzyskiwany w badaniu profil genetyczny nowotworu obejmuje, zależnie od zastosowanej metodyki:
- Informacje o punktowych wariantach (mutacjach) somatycznych a także tzw. wariantach strukturalnych w wybranych genach
- Informacje o wariantach strukturalnych – rearanżacjach i zmianach liczby kopii chromosomów lub ich fragmentów w całym genomie
Inne metody
Oprócz technologii NGS w płynnej biopsji wykorzystywane są także metody ilościowej amplifikacji DNA (qPCR) oraz kropelkowy PCR (digital PCR) do analiz ukierunkowanych na wykrywanie ściśle określonych mutacji.
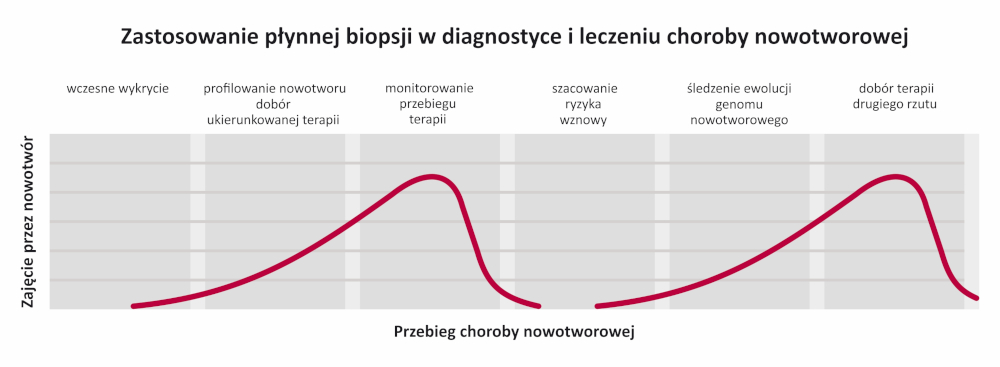
Cel badania
- Wczesna diagnoza i monitorowanie przebiegu zarówno choroby, jak i ocena skuteczności procesu leczenia.
- wczesne wykrycie obecności wariantów somatycznych i strukturalnych, potwierdzające diagnozę kliniczną
- wykrycie mutacji, „molekularnego podpisu nowotworu”, „genetycznego odcisku palca”, umożliwiające dobór ukierunkowanej terapii
- monitorowanie skuteczności zastosowanej terapii – odpowiedzi na terapię i powstania oporności na stosowane leczenie
- wykrywanie nawrotów choroby
- śledzenie ewolucji genomu nowotworowego w trakcie leczenia
- Wczesne, nieinwazyjne, niskokosztowe wykrycie rozpoczynającego się procesu nowotworowego – przed
wystąpieniem objawów.
Wczesne wykrycie rearanżacji i zmian liczby kopii chromosomów lub ich fragmentów, wskazujących na wczesny etap procesu nowotworowego – na podstawie badania całego genomu pacjenta.
Przebieg badania
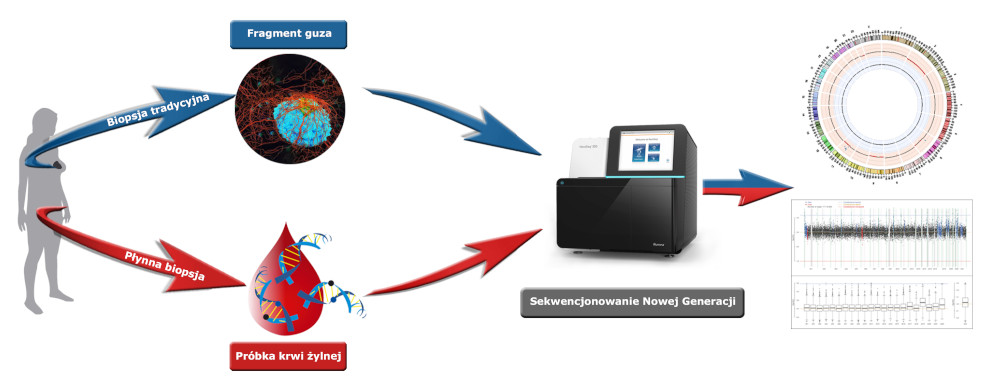
Przewaga płynnej biopsji nad biopsją tradycyjną (chirurgiczną)
- Nieinwazyjność - prostota pobrania próbki
- Możliwość uniknięcia lub odsunięcia w czasie częstokroć ryzykownej, bolesnej i trudnej procedury chirurgicznej
- Tradycyjna biopsja jest niemożliwa w przypadku przerzutów do wielu organów, nowotworów o trudnej lub nieznanej lokalizacji
- Możliwość wyprzedzenia procesu nowotworowego
- Nieiwazyjność płynnej biopsji umożliwia jej wielokrotne wykonywanie w trakcie leczenia (monitorowanie terapii)
- Pełna, reprezentatywna informacja na temat procesu nowotworowego (nie ograniczona do miejsca pobrania biopsji)
- Materiał genetyczny dobrej jakości, odpowiedni do badań metodą NGS, podczas, gdy materiał z biopsji tradycyjnej jest najczęściej uszkodzony wskutek utrwalania przy użyciu formaliny i zabezpieczania w parafinie
Spersonalizowana terapia
Przełomem ostatnich lat było wprowadzenie do praktyki klinicznej metod leczenia celowanego molekularnie na specyficzne właściwości biologiczne komórek nowotworowych.
Jak wykazano w przypadku guzów stromalnych przewodu pokarmowego (ang. gastrointestinal stromal tumors – GIST), leczeniu przewlekłej białaczki szpikowej (zastosowanie imatinibu) czy raka nerkowokomórkowego (zastosowanie sorafenibu), terapia celowana może pozwolić na przełom w leczeniu chorób nowotworowych. Przykłady skutecznego wdrożenia terapii celowanej można do tego stopnia mnożyć, iż w zasadzie pozwala nam to na wysunięcie wniosku, iż wobec większości rodzajów nowotworów wcześniej czy później opracowane zostaną nowe rodzaje leczenia celowanego molekularnie. Poprzez nakierowanie mechanizmu działania leku na istotne procesy, których funkcjonowanie w komórkach nowotworowych zostało zaburzone, w licznych przypadkach osiągnięto znaczną poprawę wyników terapeutycznych, w porównaniu do tradycyjnych sposobów leczenia, przy jednocześnie niskiej toksyczności leczenia.
Dotychczas zidentyfikowano szereg genów, których zaburzenia są powiązane z onkogenezą (ang. cancer genes). Białka kodowane przez te geny stanowić mogą dodatkowe cele terapeutyczne, zwłaszcza, iż często posiadają selektywny wzór ekspresji (wybrane tkanki i narządy), a to warunkować może niższą toksyczność tak specyficznie opracowanej terapii. Jednym z kluczowych zadań stawianych obecnie przed naukami biologicznymi w onkologii, jest poszerzanie wiedzy na temat molekularnych mechanizmów nowotworzenia oraz wskazanie szerokiego zasobu potencjalnych celów terapeutycznych, które mógłby być wykorzystane do rozwoju przyszłych metod terapii nakierowanej molekularnie.
Warunkiem zastosowania najskuteczniejszego dostępnego leczenia jest rozpoznanie typu molekularnego nowotworu. Dostępne są bazy danych gromadzące informacje o patogennych wariantach genów, powiązanych z procesami nowotworzenia, np. SANGER Institute COSMIC - Katalog Mutacji Somatycznych w Nowotworach (ang. Catalogue of Somatic Mutations In Cancer). Znając dostępny repertuar leków w terapii celowanej i typ molekularny nowotworu można optymalnie dopasować leczenia do indywidualnych potrzeb pacjenta.
Nowotwór piersi
Pokaż tabelę
Nowotwór jelita grubego
Pokaż
tabelę
Czerniak
Pokaż tabelę
Nowotwór jajnika
Pokaż
tabelę
Ograniczenia płynnej biopsji
- Trudności z wykryciem wariantów somatycznych o bardzo niskiej częstości (np. występujących tylko w części guza) wskutek rozcieńczenia w cfDNA pochodzącym ze zdrowych komórek
- Jeśli dany typ komórek nowotworowych (np. nowotwór mózgu) uwalnia małą ilość DNA do krwi, może nie być możliwe wykrycie mutacji występujących w komórkach tego nowotworu.
- Możliwość wystąpienia wyników fałszywie pozytywnych – tzn. wykrycie wariantów, które w rzeczywistości nie występują w genomie pacjenta – wynikające z bardzo wysokiej czułości badania i ograniczonej możliwości ich weryfikacji - ryzyko zredukowane dzięki zastosowaniu najnowszych technologii